Позитро́нно-эмиссио́нная томогра́фия (позитронная эмиссионная томография, сокращ. ПЭТ), она же двухфотонная эмиссионная томография - радионуклидный томографический метод исследования внутренних органов человека или животного. Метод основан на регистрации пары гамма-квантов, возникающих при аннигиляции позитронов. Позитроны возникают при позитронном бета-распаде радионуклида, входящего в состав радиофармпрепарата, который вводится в организм перед исследованием.
Позитронно-эмиссионная томография - это развивающийся диагностический и исследовательский метод ядерной медицины. В основе этого метода лежит возможность при помощи специального детектирующего оборудования (ПЭТ-сканера) отслеживать распределение в организме биологически активных соединений, меченных позитрон-излучающими радиоизотопами. Потенциал ПЭТ в значительной степени определяется арсеналом доступных меченых соединений - радиофармпрепаратов (РФП). Именно выбор подходящего РФП позволяет изучать с помощью ПЭТ такие разные процессы, как метаболизм, транспорт веществ, лиганд-рецепторные взаимодействия, экспрессию генов и т. д. Использование РФП, относящихся к различным классам биологически активных соединений, делает ПЭТ достаточно универсальным инструментом современной медицины. Поэтому разработка новых РФП и эффективных методов синтеза уже зарекомендовавших себя препаратов в настоящее время становится ключевым этапом в развитии метода ПЭТ.
На сегодняшний день в ПЭТ в основном применяются позитрон-излучающие изотопы элементов второго периода периодической системы:
углерод-11 (T½= 20,4 мин.)
азот-13 (T½=9,96 мин.)
кислород-15 (T½=2,03 мин.)
фтор-18 (T½=109,8 мин.)
Фтор-18 обладает оптимальными характеристиками для использования в ПЭТ: наибольшим периодом полураспада и наименьшей энергией излучения. С одной стороны, относительно небольшой период полураспада фтора-18 позволяет получать ПЭТ-изображения высокой контрастности при низкой дозовой нагрузке на пациентов. Низкая энергия позитронного излучения обеспечивает высокое пространственное разрешение ПЭТ-изображений. С другой стороны, период полураспада фтора-18 достаточно велик, чтобы обеспечить возможность транспортировки РФП на основе фтора-18 из централизованного места производства в клиники и институты, имеющие ПЭТ-сканеры (т. н. концепция сателлитов), а также расширить временные границы ПЭТ-исследований и синтеза РФП.
Компания Siemens AG в своих ПЭТ/КТ устройствах применяет сцинтилляционные детекторы на основе монокристаллов оксиортосиликата лютеция (Lu2SiO5, LSO).
Изобретатели: Майкл Тер-Погосян совместно с Дж. Эуджен-Робинсон, К. Шарп Кук. [1]
Позитронно-эмиссионная томография (сокращенно ПЭТ) является одним из самых информативных методов, применяемых в ядерной медицине.
В основе принципа позитронно-эмиссионной томографии лежит явление регистрация двух противоположно направленных гамма-лучей одинаковых энергий, возникающих в результате аннигиляции. Процесс аннигиляции происходит в тех случаях, когда излученный ядром радионуклида (радиоизотопа) позитрон встречается с электроном в тканях пациента.
Радиофармпрепараты, использующиеся при проведении позитронно-эмиссионных исследований представляют собой вещества, участвующие в различных метаболических процессах. При производстве радиофармпрепаратов для ядерной медицины, некоторые атомы заменяются на их изотопы. Особенностью радиофармпрепаратов, применяемых в позитронно-эмиссионной томографии является то, что при их производстве используются короткоживущие радиоизотопы, которые должны производиться в непосредственной близости от места проведения исследования. В Европе существуют специальные службы скоростной доставки радиофармпрепаратов для позитронно-эмиссионной томографии от мест их производства. Для производства радиофармпрепаратов используются специализированные медицинские циклотроны и радиофармлаборатории.
Первые клинические позитронно-эмиссионные томографы появились в начале 70-х годов прошлого столетия, однако только к концу 70-х появились первые коммерческие модели томографов. Первые аппараты были оборудованы малым числом детекторов. Не было возможности одновременного сбора информации для нескольких срезов, толщина срезов была большая. Но даже отсутствие возможности детализации анатомических структур по данным ПЭТ, не смогло задержать распространение методики в клиниках. Метод позволял получать истинно функциональные изображения, основанные на избранных метаболических цепях.
Исходно предполагалось, что основным применением ПЭТ станет кардиология, однако в настоящее более 90% исследований составляет онкология. Расширяются возможности позитронно-эмиссионной томографии для диагностики в неврологии.
Бурное развитие позитронно-эмиссионной томографии обусловлено тем, что с каждым годом появляется большое число новых радиофармпрепаратов, использование которых открывает новые горизонты использования данного метода лучевой диагностики. При этом позитронно-эмиссионная томография позволяет количественно оценивать распределение радиоактивности на мл или г ткани организма. Несмотря на длительную историю позитронно-эмиссионной томографии, в настоящее время метод непрерывно совершенствуется, появляются новые радиофармпрепараты, клинические пакеты для исследований и сами томографы. Все крупные производители медицинского диагностического оборудования разработали и выпускают позитронно-эмиссионные томографы, комбинированные с компьютерными томографами. Данные системы позволяют за одно исследование получать функциональные данные (позитронно-эмиссионные томографические изображения) и анатомические данные (рентгеновские компьютерные томографические изображения). Постоянное совершенствование аппаратного и программного обеспечения позитронно-эмиссионных томографов позволили существенно снизить лучевую нагрузку на пациента, одновременно повышая информативность исследований.
Компьютерная томография
(КТ) прочно вошла в арсенал диагностических методов современной медицины. Начиная с 1971 г. она прошла впечатляющий путь совершенствования технологии и расширения диагностических возможностей. Еще 10-15 лет назад, в начале 90-х годов прошлого века, большинство исследований проводилось на пошаговых компьютерных томографах. Тогда время исследования одной анатомической области, например груди или живота, составляло 25-30 мин., а при необходимости внутривенного контрастирования увеличивалось вдвое. В середине 90-х годов появилась технология спирального сканирования. Сегодня в клиническую практику интенсивно внедряется новая технология многослойной компьютерной томографии (МСКТ). В этом случае пучок рентгеновского излучения разделяется с помощью специального многорядного детектора на 4, 6, 8 и более томографических слоев (срезов). Для проведения рутинных исследований туловища и конечностей с успехом применяют 16-срезовые аппараты. Наивысшим достижением этой технологии стали приборы для 64-срезовой КТ, предназначенные как для общей диагностики, так и для решения проблем кардиологии и кардиохирургии. До настоящего времени КТ исследования сердца остаются наиболее сложными в технологическом плане и требуют самых технически совершенных аппаратов.
За последние годы КТ исследования существенно изменились и сегодня разительно отличаются от практики предшествующего десятилетия. С появлением МСКТ время сканирования одной или двух анатомических областей сократилось до 5-15 сек. Новые детекторы позволили уменьшить толщину томографических срезов до 0,5-1,5 мм и выявлять патологические изменения размером 1-2 мм. При этом количество получаемых томограмм увеличилось от традиционных 15-25 до нескольких сотен и даже тысяч. Конечный результат исследования может быть представлен не только как набор аксиальных томограмм, но и в виде трехмерных интерактивных моделей изучаемой области, раскрывающих мельчайшие детали нормальной и патологической анатомии. Интенсивное развитие получили наиболее трудные для обычной КТ направления, такие как исследования сердца и сосудов, желудочно-кишечного тракта, трехмерное моделирование и виртуальная эндоскопия.
Тем не менее, сегодня уже очевидно, что появление в клинической практике МСКТ не является конечным этапом развития метода. Скорее наоборот, технологические преобразования последнего десятилетия создали прочный фундамент для его дальнейшего развития. Процесс совершенствования технологии стимулируется не только возрастающими потребностями клиники, но и интенсивным развитием других, параллельных технологий диагностической радиологии, таких как, например, магнитно-резонансная или позитронно-эмиссионная томография.
Ведущие мировые компании, занимающиеся разработкой и производством медицинской техники, предлагают различные варианты технологий будущих аппаратов для КТ исследований. К ним можно отнести увеличение числа томографических срезов до 128, 256 и даже более, использование в качестве детектора рентгеновского излучения, так называемые, плоские панели (flat panels), которые сегодня с успехом применяются в цифровых рентгеновских аппаратах. В этом ряду одним из наиболее перспективных направлений является технология КТ с двумя источниками излучения - dual source CT. Она разработана компанией Сименс и представлена в виде полноценного диагностического прибора в конце 2005 года. В течение последующих полутора лет сотни подобных аппаратов были установлены в ведущих клиниках различных стран мира, идет подготовка к монтажу двух приборов в нашей стране. Следует отметить, что аппарат SOMATOM Definition компании Сименс, основанный на технологии двух источников излучения - это единственный на сегодняшний день перспективный проект в области новых технологий КТ, успешно реализованный в клинической практике.
В чем особенности технологии КТ с двумя источниками излучения.
Внешне аппарат имеет большое сходство с обычным компьютерным томографом. Вертикально расположенная сканирующая система и горизонтальный стол для пациента. Основное отличие заключается в том, такие аппараты имеют две рентгеновские трубки и два блока детекторов. Каждая пара «рентгеновская трубка/многорядный детектор» закреплены на внутренней поверхности кольца гентри под углом 900 друг к другу и обеспечивают одновременный сбор данных в 128 срезах (64 х 2 среза). Каждый детекторный блок имеют величину коллимации 0,6 мм для центральных рядов и 1, 2 мм - для наружных. При сканировании использована технология плавающего фокусного пятна, разработанная компанией Сименс еще для 64-срезовых аппаратов, которая позволяет визуализировать анатомические объекты с изотропным пространственным разрешением 0,33 мм.
Для чего создана столь сложная конструкция? Основная задача - максимально сократить время сбора проекционных данных. Время оборота рентгеновской трубки вокруг пациента - один из критических параметров в компьютерной томографии. Сегодня своеобразным рекордом является 330 мс или 0.33 с. Это означает, что за одну секунду двухтонное кольцо гентри с закрепленными на нем рентгеновской трубкой, многорядным детектором и другими приборами, совершает три полных оборота вокруг пациента. Однако даже этой скорости недостаточно, чтобы получить гарантированно четкое изображение анатомических структур сердца. Периодические сокращения сердечной мышцы, особенно в условиях тахикардии, приводят к появлению динамических артефактов и искажению изображения. В результате сложная дорогостоящая процедура может оказаться не информативной. Для преодоления именно этого недостатка и был предложен аппарат с двумя источниками излучения. Однако потенциальные возможности созданного прибора оказались гораздо более широкими, чем только сокращение времени сканирования. Сегодня можно выделить несколько основных направлений использования новой технологии КТ: кардиология и, прежде всего, изучение коронарных сосудов, комплексное исследование отдельных анатомических областей для решения самостоятельной клинической проблемы, например, острая боль в груди, использование двухэнергетической томографии и ряд других.
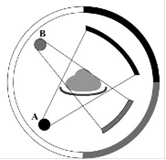
Рис. 1. - Схема компьютерного томографа с двумя источниками
излучения и двумя блоками детекторов, закрепленных на внутренней
поверхности вращающегося кольца гентри
Подбор очковой коррекции |
Закаливание организма |
Гигиена полости рта |
